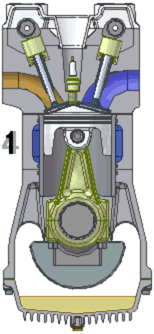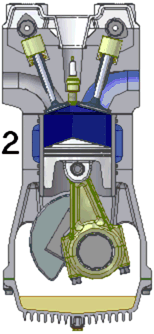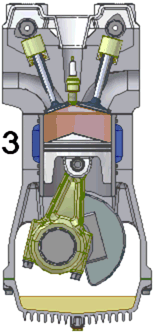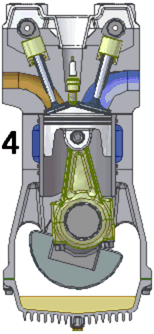
La majorité des moteurs utilisés dans l’industrie automobile sont des moteurs thermiques à combustion interne et fonctionnant en quatre temps.
Le fonctionnement repose sur la combustion dans les chambres de combustion d’un mélange air-essence. Le mélange idéal pour cette combustion est 1g d’essence pour 14,6g d’air, on parle alors de mélange stœchiométrique.
Le fonctionnement du moteur s’effectue en quatre temps (cf schéma ci dessus):
1) L’admission : le piston descend et aspire ainsi le mélange air-essence qui rentre par la soupape d’admission. La chambre de combustion est alors remplie par le mélange.
2) La compression : le piston remonte et comprime le mélange dans le cylindre.
3)La combustion : une étincelle, générée par la bougie, enflamme le mélange. L’explosion fait redescendre le piston
4) L’échappement : le piston remonte et évacue les gaz brûlés par la soupape d’échappement.
------------
Un carburant, par définition , est un combustible qui alimente un moteur thermique. Ce dernier transforme l'énergie chimique du carburant en énergie mécanique. Comme son nom l'indique, un carburant contient du carbone. On peut distinguer différents carburants : les biocarburants, provenant de végétaux par exemple, et les carburants dits "fossiles" qui proviennent de la transformation des matières organiques mortes mélangées à divers minéraux. De nos jours, le carburant le plus commun est l'essence : il s'agit d'une substance obtenue par distillation du pétrole et par conséquent très inflammable.
Nous nous sommes spécialement intéressés au cas du bioéthanol ; un combustible contient obligatoirement des atomes de carbone puisqu'il rejette du dioxyde de carbone lors de la combustion. Le bioéthanol, de formule C2H6O , contient bien des atomes de carbone. Il est donc bien combustible, et est donc un biocarburant puisqu'il provient de la fermentation de levures, comme vu dans la première partie. En revanche, son taux de combustion est inférieur à celui de l'essence; il ne peut donc être utilisé à lui seul en tant que biocarburant pour faire fonctionner un moteur quatre temps. Il faut donc créer une solution d'essence et de bioéthanol pour faire fonctionner un moteur quatre temps.
Dans le cadre de notre TPE, nous nous sommes occupés de l'utilisation de l'éthanol comme carburant pour un moteur n'ayant subi aucune modification.
Le but de cette manipulation est de voir en quelles proportions d'éthanol et d'essence une solution peut elle servir de carburant pour un moteur quatre temps d'une tondeuse non modifié. Pour cette manipulation, nous avons utilisé de l'éthanol, procuré en pharmacie, puisque la quantité obtenue en bioéthanol dans la première partie ne fut pas suffisante. Par ailleurs, l'intérêt ici est la concentration en molécule d'éthanol dans le carburant. La méthode d'obtention de cette molécule n'est donc pas importante, mais nous considérerons que nous disposons d'une solution à 100% d'éthanol, obtenu biologiquement.
-Mélange à 10% d'éthanol pour 90% :Pour un volume V de 500 mL, nous avons introduit 450 mL d'essence et 50 mL d'éthanol.
La tondeuse fonctionne sans signe de faiblesse !
-Mélange à 30% d'éthanol. La solution dans la tondeuse ayant un volume de 500mL et une concentration de 10% d'éthanol, il a fallu rajouter 85 mL d'éthanol pour augmenter la concentration jusqu'à 30% d'éthanol. Ainsi, le nouveau volume total V' a l'intérieur de la tondeuse est de 585 mL, dont un volume Veth d'éthanol de135 mL et un volume Vess d'essence de 450mL. La concentration C' en pourcentage est donc de:
C'= Veth/Vess * 100 =30%
La tondeuse fonctionne, mais le moteur a quelques signes de faiblesse : le bruit est assez rauque
-Mélange à 50%. La solution dans la tondeuse ayant maintenant un volume de 585mL et une concentration de 30% d'éthanol, il a fallu rajouter 90 mL d'éthanol pour augmenter la concentration jusqu'à 50% d'éthanol. Ainsi, le nouveau volume total V'' a l'intérieur de la tondeuse est de 675 mL, dont un volume Veth' d'éthanol de225 mL et un volume Vess' d'essence de 450mL. La concentration C'' en pourcentage est donc de:
C''= Veth'/Vess' * 100 =50%
La tondeuse démarre et s'arrête quasiment immédiatement: plusieurs hypothèses s'offrent à nous :
- La solution n'est donc plus assez combustible
- Le moteur a été endommagé
- L'injection du carburant n'est plus assez importante
En effet le pouvoir calorifique de l'éthanol, autrement dit l'énergie qu'il dégage lors de sa combustion, est inférieur à celui de l'essence (21200kj/L contre 35475kj/L pour l'essence). Il faudra ainsi injecter plus de carburant dans le moteur pour permettre à ce dernier de fonctionner "normalement".
De ce fait, des modifications au niveau des injecteurs devront être faites mais ceci sort du cadre de notre TPE.
Ainsi, sans modifications du moteur, une automobile peut rouler avec un mélange contenant un quantité inférieur à 10% d'éthanol sans réel risques pour sa mécanique. Certains moteurs de voiture tolèrent jusqu'à 20% d'éthanol mais il est déconseillé d'aller au delà.








